Sociedad Argentina de Mastología
Sociedad Argentina de Radiología
Sociedad Argentina de Patología
Sociedad Argentina de Cancerología
Instituto de Oncología Ángel H. Roffo
Sociedad Argentina de Terapia Radiante Oncológica
INTRODUCCION
El cáncer de mama es el tumor más frecuente en la mujer, representando el 31% de todos los tumores de la población femenina. Se estima que una de cada ocho mujeres que alcancen la edad de 85 años habrá desarrollado un cáncer de mama en el curso de su vida.
Existen poblaciones de mayor y menor riesgo de padecer cáncer de mama. Así, su incidencia es mayor en Estados Unidos, Inglaterra y Europa del Norte, mientras que es muy baja en Japón y China. Esto parecería deberse más a factores ambientales, de costumbres y hábitos alimentarios que a factores raciales. Se ha visto que los grupos de orientales que emigran a Estados Unidos, luego de la segunda generación, presentan una incidencia similar a la del país huésped.
Por otro lado, países como Japón y áreas urbanas de China, han visto un aumento de la incidencia en los últimos años, posiblemente debido a la “occidentalización y globalización” de las costumbres.
La incidencia se ha incrementado en los últimos años, en forma relativa debido a la difusión de la
mamografía, pero también debido a los cambios en los hábitos de vida, reproductivos y otros factores.
El cáncer de mama ocupa el primer lugar entre las causas de muerte por cáncer en la mujer adulta, con una tasa ajustada de mortalidad de 27.32/100 000 mujeres en Argentina.
En la Región de América Latina, las tasas de mortalidad por cáncer mamario están en aumento y
registran niveles sin precedentes en muchos países, como Colombia, Costa Rica, México , Puerto Rico, Uruguay y Venezuela.
En la República Argentina, 5219 mujeres murieron por causa del cáncer de mama en 2001.
La mortalidad por cáncer de mama fue mayor en las jurisdicciones del centro del país como Santa Fe, Córdoba, Ciudad de Buenos Aires y San Juan, con tasas, hasta tres veces más altas que el promedio nacional.
El 75% de las muertes se registró en las jurisdicciones de Buenos Aires, Ciudad de Buenos Aires,
Córdoba y Santa Fe. La mortalidad más alta se registró en el grupo de mayores de 70 años, con una tasa de 164 por 100.000 mujeres.
Aunque la información sobre morbilidad es escasa, se estima que en Argentina ocurren 10.500 y 21.000 casos nuevos de cáncer de mama por año teniendo en cuenta la información de incidencia de los Registros de Tumores de Concordia y de Bahia Blanca, respectivamente. La mayoría de los mismos son detectados tardíamente, por lo que son más bajas las probabilidades de curación. En la actualidad, Argentina no tiene un programa de detección precoz del cáncer de mama.
Lesiones mamarias que no son palpables ya sea por su tamaño pequeño, localización profunda, o
consistencia similar al parénquima mamario, y sólo son detectadas por mamografías, ecografías
mamarias o algún otro método de imágenes.
El concepto de cáncer no palpable, no significa siempre que sea pequeño, a veces puede omprometer todo un cuadrante y permanecer no palpable, como por ejemplo algunos carcinomas no invasores.
La jerarquía de este consenso radica no sólo en el crucial manejo de este tipo de lesiones, sino en la mayor importancia del hallazgo de las mismas.
Para ello es fundamental la concientización con respecto a la detección precoz, incentivando el control y screening mamario.
En esta publicación se incluyen las recomendaciones e indicaciones de estudios mamarios, con una breve descripción de cada uno de los métodos diagnósticos, el concepto de clasificación de imágenes por el sistema de BI-RADS, descripción de las imágenes, recomendaciones de conductas y de estudio histopatológico.
CAPITULO I DETECCION Y DIAGNOSTICO IMAGENOLOGICO.
RECOMENDACIONES DE ESTUDIOS
En el cáncer de mama el pronóstico está estrechamente ligado al momento de la detección, sabiendo que el diagnóstico temprano evita y disminuye en gran medida los procedimientos quirúrgicos radicales, atenúa la repercusión psíquica y sociofamiliar desencadenados de la propia patología y la amputación que se indica para su tratamiento.
A la vez el tratamiento temprano puede evitar las terapéuticas adyuvantes y disminuye los costos que genera la mayor utilización de insumos en las sucesivas etapas de la enfermedad.
Las actividades de prevención primaria para evitar la aparición del problema sólo pueden hacerse a nivel de recomendaciones a cambio de estilo de vida saludables: lactancia materna, dieta con bajo contenido de lípidos, aumento de la actividad física, evitar el tabaquismo. Existen estudios en curso que evalúan diversas intervenciones farmacológicas tendientes a lograr la prevención primaria de la enfermedad (quimioprevención). No obstante, la herramienta más efectiva para lograr la reducción de la mortalidad generada por esta patología, hoy en día, es la prevención secundaria mediante el diagnóstico precoz, en estadios iniciales con el estudio de la mujer asintomática.
Beneficios del Control mamográfico:
Los beneficios del screening mamario, han sido demostrados en numerosos estudios
randomizados, desde mediados de la década de 1980 a la fecha. En dichos estudios se ve una reducción del índice de mortalidad por cáncer de mama en por lo menos un 25%. Esto quedó claramente demostrado en la población de 50 años o más, y en los últimos años, una gran parte de las sociedades científicas internacionales recomendaron comenzar el “tamizaje o screening” partir de los 40 en forma anual (Recomendaciones del ACR 1997)
El riesgo de padecer cáncer de mama para una mujer promedio es del 13%, o sea que una cada 8
mujeres, tiene la posibilidad de padecer cáncer de mama a lo largo de su vida. Las mujeres con un pariente de primer grado (madre, hermana, hija) que haya padecido cáncer de mama tienen un riesgo de dos a cuatro veces mayor, que la población femenina en general.
El alto riesgo familiar queda definido por 2 tumores de mama u ovario en una sola persona o
varias, en familiares de I grado (madre, hermanas, hijas). En familiares de II y III grado (el resto de la familia), se requieren 3 tumores o más con similar distribución.
A partir de los 20 años, las mujeres pueden comenzar a realizarse su autoexamen mamario una
vez por mes. El mejor momento para realizarlo es de 7 a 10 días después del comienzo del ciclo
menstrual, cuando las mamas están menos tensionadas.
El valor real del autoexamen mamario, sigue siendo debatido por cuanto su aplicación no logró
beneficios en la mortalidad, no obstante lo cual mantiene su importancia en el hecho de la
concientización por parte de la mujer del cuidado de sus mamas.
Anualmente por médico especialista, a partir de los 30 años.
No existe evidencia de que el examen médico por si solo logre reducir la mortalidad por cáncer
de mama. Sin embargo una proporción de los carcinomas diagnosticados en los ensayos clínicos ha sido por este método. Por eso es que se lo incluye acompañando al examen mamográfico.
Se debería efectuar una mamografía de base a partir de los 35 años, y se debe realizar una por
año a partir de los 40 años, en mujeres asintomáticas y sin antecedentes familiares de cáncer de mama.
En casos de poseer antecedentes familiares, especialmente si presentaron esta enfermedad antes de los 50 años, los estudios mamográficos deberían comenzar 10 años antes de la edad de presentación del caso en cuestión.
Mientras que no haya suficiente información, la edad límite para sugerir finalizar los controles
mamarios, debe ser evaluado en cada caso en particular.
Puesto que todavía no hay forma de predecir quién desarrollará cáncer de mama y quién no, todas las mujeres deberían ser estimuladas a su evaluación antes que haya cualquier signo o síntoma de la enfermedad.
La mamografía debe ser realizada en un mamógrafo de alta definición, en dos incidencias frente y medio lateral oblicuo. También se podrán realizar tomas adicionales como mamografías magnificadas y focalizadas, y tomas especiales para ver en particular alguna lesión de difícil localización.
Los lugares de realización de las mamografías deberían cumplir con la Guía de Delineamientos Básicos en el Control de Calidad en Mamografía y Programa Nacional de Garantía de Calidad de la Atención Médica, Ministerio de Salud y Medio Ambiente, Resolución 233/2000, la cual todavía no ha sido implementada en forma oficial.
En el estado actual de los conocimientos, está justificada la exploración mamográfica en todos
los casos que se describen a continuación.
Para asegurar la inclusión de todo el tejido mamario en la imagen, la exploración debe incluir dos
proyecciones por mama.
Mujeres a partir de los 40 años (inclusive), con periodicidad anual.
Mujeres con antecedentes familiares directos de carcinoma de mama: madre, hermana o hija, a partir de los 35 años o 10 años antes del familiar más joven con cáncer de mama, con
periodicidad anual.
Mujeres con factores considerados de riesgo para cáncer de mama.
Mujeres sometidas a tratamiento hormonal sustitutorio, de cualquier edad.
Pacientes con sintomatología mamaria no aclarada.
Pacientes de cualquier edad, a las que se ha diagnosticado un cáncer mamario por otros métodos diagnósticos, y no dispongan de mamografía, como estudio basal de referencia.
Pacientes de cualquier edad, con enfermedad metastásica demostrada, sin tumor primario
conocido.
Pacientes con antecedentes personales de cáncer mamario, con periodicidad anual.
Previa a cualquier operación mamaria, no importa la patología.
Amplificación (Magnificación) / Compresión localizada / perfil estricto / tomas tangenciales:
Imágenes mamográficas de existencia dudosa, para confirmar o descartar su verdadera presencia.
Imágenes mamográficas de presencia real, para una mejor evaluación radiológica.
Correlacionar imágenes detectadas mamo-ecográficamente.
Es un estudio complementario a la mamografía. No es un método de screening. El mismo debe
efectuarse guiado por la clínica o la mamografía. Es un método útil para las mujeres premenopáusicas con sintomatología mamaria, ideal para evaluar lesiones quísticas, en mujeres embarazadas o en período de lactancia.
Deberá realizarse con transductores adecuados para el examen mamario, lineales y de 7,5mhz o más, y si es posible con el estudio mamográfico disponible para corroborar la imágenes.
Sus indicaciones más frecuentes son:
Mamas o nódulos mamográficos
Mamas densas con o sin sintomatología clínica.
Asimetrías y/o imágenes mamográficas no concluyentes (distorsiones o opacidades)
Masas palpables.
Procesos inflamatorios.
Primera evaluación en pacientes menores de 30-35 años.
Guía de procedimientos intervencionistas.
Evaluación de las prótesis.
El objetivo fundamental del diagnóstico por imágenes de la mama en lo referente a patología
neoplásica consiste no sólo en Descubrir, Caracterizar y Estadificar sino también descartar su
existencia.
La RM con contraste en el estudio de la mama cumple, por su alto Valor Predictivo Negativo
(sensibilidad), el objetivo de descartar patología tumoral infiltrante.
Hay diferentes técnicas y protocolos de evaluación, pero siempre que se evalúa el parénquima mamario se debe utilizar contraste paramagnético (Gadolinio). La RM con inyección de gadolinio ha demostrado poseer gran sensibilidad para la detección del cáncer de mama y particularmente para los cánceres infiltrantes. Pero esta sensibilidad se ve moderada por una baja especificidad. Los criterios morfológicos, tales como los contornos lesionales (espiculados, lisos), y las imágenes de alta resolución mejoran la especificidad sin disminuir la sensibilidad.
Las indicaciones de la Resonancia mamaria esta en evolución permanente, y hay que tener en cuenta que es fundamental la tecnología disponible, la experiencia y capacitación de los rofesionales actuantes. No es una técnica de primera indicación y su empleo debe quedar para los casos en que los estudios previos no sean concluyentes.
Entre las ventajas de este método encontramos que es una vista tridimensional del parénquima mamario, tiene alta sensibilidad en mamas densas y no utiliza radiación ionizante. Entre sus desventajas se destacan su alto costo, la variabilidad en la realización de los estudios (protocolos), su moderada especificidad, y que no detecta eficientemente las microcalcificaciones.
La Resonancia en mama es de gran ayuda para:
Evaluar la extensión local de la enfermedad, en el cáncer preoperatorio
Evaluar los implantes mamarios
Evaluar la mama operada e irradiada
En el carcinoma oculto por imagenología convencional
Screening en mujeres jóvenes de alto riesgo
Monitoreo de respuesta al tratamiento quimioterápico
Descartar enfermedad mamaria en caso de sospecha
Denominación: Punción biopsia histológica/con aguja gruesa de lesiones no palpables,
biopsia core o Core biopsy, punción percutánea,
en una mesa destinada exclusivamente para estos procedimientos.
2 -Ecográfica: se utiliza los mismos equipos que para los estudios mamarios de rutina.
3 -Resonancia magnética: Se debe tener el instrumental adecuado.
La guía de elección debe ser donde se vea con mayor claridad la lesión. Siempre que se pueda se debe elegir la vía ultrasónica, debido a que es la más directa hacia la lesión, la más cómoda para la paciente, la más económica y no utiliza radiaciones ionizantes.
a) Biopsia/punción Histológica con Aguja Gruesa (BAG) o “Core biopsy”: en la que se emplean
agujas de un calibre habitualmente comprendido entre 14 y 12G. Tales agujas (habitualmente
conectadas a pistolas de disparo automático) permiten obtener cilindros tisulares mediante corte distal o lateral.
b) Biopsia Histológica Asistida por Vacío (BAV) o “mammotome”: en la que se emplean agujas de
mayor calibre (de 11- 8G) conectadas a un sistema de vacío que posibilita la toma de cilindros
tisulares de gran tamaño. Tales agujas incorporan en su interior un bisturí de corte circular que
permiten seccionar el tejido tras la aplicación del vacío.
Este tipo de biopsias son diagnósticas, no terapéuticas.
Siempre que se indique una punción histológica percutánea, deberá evaluarse la accesibilidad de la lesión, y factibilidad de la punción.
Deberá realizarse siempre con control de imágenes.
Agujas calibre no inferior a 14G.
Mínimo 5-10 muestras por lesión.
Imágenes pre y post punción.
Confirmación de las microcalcificaciones en las muestras obtenidas. Para ello realizar una mamografía de los especímenes sin formol. Se realizará una técnica con magnificación . Si no se identifican microcalcificaciones en la mamografía de control, la probabilidad de error de muestreo es alta. Si no se reconocen las microcalcificaciones en las Rx de los especimenes se recomienda repetir la toma de muestras o realizar una biopsia radio quirúrgica Si luego de la biopsia se ha extraído toda la lesión mamográfica o ecográfica, estaría indicada la colocación de una marca (Ej.: clip de titanio o de acero inoxidable) para señalar el sitio de la lesión.
El resultado de la anatomía patológica de una punción histológica debe ser concordante con la sospecha imagenológica de la lesión. En caso de no ser así se recomienda la biopsia radio quirúrgica para su corroboración diagnóstica.
Ante el diagnóstico histológico de hiperplasia atipica, carcinoma ductal ó lobulillar in situ, cicatriz
radiada ó determinados tipos de papilomas se sugiere realizar biopsia quirúrgica ó radio-quirúrgica para evitar el sub-diagnóstico de la lesión.
Biopsia quirúrgica, “a cielo abierto”, para resecar imágenes no palpables de la mama. Es un
procedimiento que permite la resección completa de la lesión no palpable con margen de tejido sano.
Se debe realizar una marcación previa a la operación, guiada por el método de imágenes que mejor visualice la lesión (mamografía o ecografía)
Debe corroborarse la extracción de la lesión durante la operación, mediante una mamografía o ecografía de la pieza operatoria. No se recomienda realizar una biopsia radio quirúrgica si no se cuenta con un mamógrafo disponible en las cercanías del quirófano para la realización de este procedimiento
En caso que las microcalcificaciones no estén en la pieza en su totalidad, se ampliará la resección.
Se recomienda marcar la pieza con algún tipo de material radiopaco (hilos o clips) para su ubicación espacial en la mamografía.
Es recomendable marcar el lugar exacto de las microcalcificaciones con un hilo o aguja para facilitar su localización al patólogo y el procesamiento histológico. Si es posible, antes de este procesamiento es recomendable el corte de la pieza en láminas y mamografías de las mismas para mejor ubicación de las microcalcificaciones.
No debería realizarse estudio por congelación en las microcalcificaciones solas. A criterio del Mastólogo se puede realizar en el caso que esté asociado a opacidad o distorsión.
La biopsia radioguiada consiste en una BRQ marcada con radioisótopos, guiada con gammaprobe
(sonda para detectar radioactividad), asociado a la marcación de ganglio centinela. Se realiza biopsia por congelación por tratarse de nódulo o masa. Si se confirma un carcinoma se biopsia por congelación el ganglio centinela. Este procedimiento puede ser diagnóstico y terapéutico a la vez.
La terminología empleada para las imágenes mamográficas se ha ido modificando a través del tiempo, dando origen a marcadas diferencias en el lenguaje utilizado. La estandarización en la descripción de las imágenes halladas es imprescindible para evitar confusiones y asegurar la comprensión del informe. Con ese objetivo se han desarrollado diversas clasificaciones de imágenes mamarias.
El sistema BI-RADS (BREAST IMAGING REPORTING AND DATA SYSTEM) preconizado por el Colegio Americano de Radiología (ACR), es uno de los más utilizados, y tiene la gran ventaja de unificar el “lexicón” o lenguaje a utilizar. Este sistema de uso corriente y obligatorio en USA ya ha sido adoptado en muchos países, sin embargo en nuestro país todavía no es de uso obligatorio.
Para los fines de este consenso, se ha considerado el más adecuado para unificar criterios.
El concepto de “masa” según el BI-RADS es definido como “lesión ocupante de espacio vista en dos proyecciones diferentes” (Figura 1). Si se ve en una única proyección debería ser llamada densidad o asimetría hasta que su carácter tridimensional haya sido confirmado.
Se utilizará el término opacidad o imagen nodular asumiendo la definición utilizada para nódulo o masa, a los fines didácticos.
El concepto de nódulo se aplica tanto para lesiones sólidas como quísticas, aunque en mamografía no debe asumirse a priori ninguna de las dos hasta que no sea confirmado en un estudio ecográfico (Fig. 3 CATEGORIAS BIRADS 2006).
B. CALCIFICACIONES
El Colegio Americano de Radiología (ACR) las divide en Benignas, Intermedias y Alta Probabilidad de Malignidad.
El límite para distinguir las calcificaciones de las microcalcificaciones es 0,5 mm (500μ).
1-Benignas
a)Calcificaciones de piel
b)Citoesteatonecrosis (Centro translúcido)
c)Del fibroadenoma (Groseras)
d)Microquistes (“taza de té”)
e)Ectasia ductal (Varillas)
f)Calcificaciones distróficas
g)Calcificaciones de sutura
h)Quiste oleoso (Cáscara de huevo)
i)Calcificaciones vasculares
j)Lobulillares (Redondas)
k)Puntiformes
2-Intermedias
a)Heterogéneas
b)Amorfas
a)Granulares o pleomórficas
b)Lineales o moldeadas
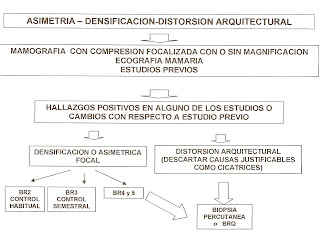
C . ASIMETRIAS-DENSIFICACIONES-DISTORSIONES
Definiciones:
a. Tejido mamario asimétrico
b. Densidad Asimétrica focal
c. Distorsión arquitectural
Representa mayor volumen o densidad de tejido mamario en una mama, con respecto a la mama contralateral generalmente en un área extensa. No se visualiza masa focal, distorsión de la arquitectura ni microcalcificaciones.
Puede deberse a cirugías previas, o ser una variante de la normalidad.
Es una densidad volumétrica de tejido, con morfología similar, que carece de bordes y de entidad para describirla como masa.
Puede representar una variante de la normalidad, o ser debida a cirugía, biopsia, traumatismo previo, tratamiento hormonal sustitutivo o carcinoma mamario.
Representa la ruptura en un sitio determinado de las líneas de fuerza de la trama glandular, una
reorganización del tejido mamario hacia un punto excéntrico del pezón. Se considera BR 4.
EL INFORME IMAGENOLOGICO
Basado en la categorización del Colegio Americano de Radiología. BI-RADS 2003.
La confección del informe pretende lograr con un lenguaje conciso, definido y comprensible tanto lo que respecta a la composición del tejido mamario como a la descripción de las imágenes halladas y su correcta localización. La categorización hecha de acuerdo al grado de sospecha de cáncer deberá ser precisa y establecerá, por lo tanto, la conducta a seguir.
La decisión final respecto de dicha conducta es resorte exclusivo del especialista en Mastología o del médico tratante calificado.
El léxico adoptado es un magnífico intento de estandarizar la descripción de los hallazgos
imagenológicos mamarios, en un esfuerzo por reforzar la comprensión del informe.
El sistema es flexible y permeable para ser modificado, si hubiese base científica o casuística que lo justifique.
1) Motivo de consulta
2) Composición del tejido mamario
3) Hallazgos (Mx, Us)
Conciliación clínica, Mx, Us y est. anteriores
Categorización (BI-RADS)
4) Conclusión y recomendación
En general, el nuevo criterio es constarlo. La cuarta edición de BI-RADS considera que se debe iniciar el reporte describiendo cual fue la causa que motivó el examen. Si bien es cierto que la mamografía puede detectar la mayoría de los cánceres, debemos recordar que hay cánceres clínicos que no tienen representación mamográfica.
Manifestaciones clínicas (nódulo, derrame, retracción de pezón, de piel, etc.)
Antecedentes personales y/o familiares
Control anual
Primer control mamográfico
Control de mama operada
Seguimiento de lesión (BI-RADS 3)
Complemento de estudio incompleto (BI-RADS 0)
Prótesis mamaria
Tiene la finalidad de informar la característica del tejido mamario, mostrando la facilidad de lectura en una mama adiposa y las dificultades cuando hay predominio de tejido fibroglandular:
Mamas lipomatosas (translúcidas)
Mamas con tejido fibroglandular disperso
Mamas con predominio de tejido fibroglandular (densas)
Mamas totalmente fibroglandulares (opacas o densas)
Es la parte más relevante del informe. Las imágenes halladas pueden ser: los nódulos, las
calcificaciones, las distorsiones, las asimetrías, los hallazgos asociados y las misceláneas.
Localización
Cuando las imágenes son pequeñas y no palpables, la descripción de su localización debe ser lo más exacta posible para facilitar su punción y/o extracción.
Obtenida la imagen en las dos incidencias mamográficas, se la debe proyectar extrapolando su ubicación con la clínica.
o Forma
o Tamaño
o Cantidad
o Márgenes
o Densidad
o Comportamiento ecográfico
o Evolución
Calcificaciones
o Tamaño
o Forma
o Homogeneidad
o Distribución
o Densidad
o Evolución
o Tamaño
o Densidad
o Contornos
o Comportamiento ecográfico
o Evolución
o Comportamiento ante la compresión
o Comportamiento ecográfico
o Evolución
o Ganglios intramamarios
o Ganglios axilares
o Ductos dilatados
o Retracción de piel
o Retracción de pezones
o Engrosamiento de la piel
o Evolución
Categorización (BI-RADS) - recomendado aunque no obligatorio -
La conclusión radiológica que es quizás el aporte más importante del informe. Es a veces lo único que lee el médico referente, por lo que debe contener con claridad la descripción de la imagen hallada. Se recomienda acompañar de la categorización de BI-RADS.
CAPITULO II. MANEJO CLINICO-QURURGICO
ALGORITMOS Y CONDUCTAS ANTE LESIONES MAMARIAS SUBCLINICAS
Se describen algoritmos diagnósticos para nódulos, microcalcificaciones y asimetrías no palpables.
Siendo el Mastólogo como médico de atención primaria de la paciente quién tomará las decisiones
ponderando las sugerencias recibidas.

Identificada una opacidad o imagen nodular mamográfica:
-Reevaluar clínicamente el sector, dirigido por la ubicación radiológica buscando la posibilidad
de palparla.
-Mamografías con compresión focalizada con o sin magnificación : para distinguir la
superposición de imágenes, confirmar densidades, contornos, forma y exacta localización de la
lesión. Para esto último se puede realizar un perfil estricto a 90º. También puede aportar lesiones asociadas como microcalcificaciones.
-Realizar una ecografía mamaria para evaluar el nódulo, si se define como quístico o sólido.
-Si no tuviera traducción ecográfica debe seguirse el algoritmo de nódulo sólido.
-Si en proyecciones complementarias no se confirma la presencia de nódulo y la lesión
identificada corresponde a una densidad asimétrica o distorsión arquitectural, se seguirá con el
algoritmo de asimetrías.
Quiste simple: Control. Se recomienda punción evacuadora con aguja fina y guía ecográfica
únicamente si existen dudas sobre su naturaleza quística (presencia de ecos internos por efecto de la ganancia), en casos de gran dolor, o aumento de tamaño.
Quiste complicado: se define como aquel que no cumple con los criterios estrictos de simple.
Incluye: contenido ecogénico(ecos finos o gruesos). Puede estar asociado o no a inflamación y/o
fibrosis. Se puede realizar punción citológica o histológica.
Quiste Complejo o con lesión sólida focal intraquística: se aconseja su resección quirúrgica,
sin punción previa, ya que podría desaparecer la imagen e imposibilitar su resección, además un
20-25% de posibilidad de carcinoma.
2. Nódulos Sólidos:
A. Nódulo Sólido sugestivo de benignidad BR 3:
Ante un nódulo sólido BR3 que se mantiene estable, en pacientes sin antecedentes de riesgo, se sugiere control imagenológico en 6 meses durante 3 años. Luego, si no se modifica, puede bajar la categoría en la clasificación.
Factores a Considerar para indicar estudio histológico:
1. Si el nódulo: aumenta de tamaño en controles sucesivos, se vuelve palpable, o presenta cambios en forma o disposición (dejaría de ser BR3 por definición).
2. Si el nódulo es de nueva aparición, especialmente en pacientes perimenopáusicas(dejaría de ser BR3 por definición).
3. Si la paciente tiene mayor riesgo para desarrollar cáncer de mama (x ejemplo por antecedentes familiares o por hiperplasias atípicas, Gail >1,66, etc.)
4. Imposibilidad de seguimiento
5. Deseo de la paciente
El estudio puede realizarse por punción histológica percutánea o biopsia radio quirúrgica. Si ésta es benigna, pasa a ser BR2.
B. Nódulo Sólido con sospecha de malignidad BR 4
Se debe efectuar su confirmación histológica.
C. Nódulo Sólido con alta sospecha de malignidad BR 5
Se debe efectuar su confirmación histológica.
La posibilidad de realizar una punción histológica previa, confirmando o no el diagnóstico de
carcinoma, puede ser de ayuda para el profesional actuante, permitiendo planificar la estrategias terapéuticas (ganglio centinela, reconstrucciones), los márgenes quirúrgicos y disminuir la tasa de reoperaciones. Pero en caso de no poder realizarse, se recomienda la resección quirúrgica previa marcación de la lesión, con buen margen quirúrgico.
MICROCALCIFICACIONES

En microcalcificaciones BR3 hay que evaluar los cambios en el tiempo, si se nota un aumento en
número, cambio de forma o tendencia a una mayor agrupación , podrá indicarse una punción histológica
Si los hallazgos se pierden el las incidencias especiales o en la ecografía son pasibles de control
En las distorsiones es importante descartar cicatrices previas u otra causa justificable y
compararlas con estudios anteriores.
3) CAPITULO III DIAGNOSTICO ANATOMO-PATOLÓGICO.
RECOMENDACIONES PARA EL ESTUDIO ANATOMOPATOLOGICO
DE LESIONES NO PALPABLES
La biopsia y/o pieza operatoria debe ser remitida al patólogo:
Con datos de filiación (identificación, edad, etc.), lugar de la lesión (identificación de lado mamario y cuadrante), carácter de la lesión (nódulo, microcalcificaciones), clasificación de BI-RADS y, de ser factible, la mamografía diagnóstica que motivó la realización de la biopsia.
En forma íntegra, sin seccionar.
Adjuntada la placa mamográfica de la pieza quirúrgica, referenciada y orientada con identificación de márgenes quirúrgicos (ejemplo: sup/medio/interno/etc) mediante el uso de clips, suturas o cualquier otro elemento disponible.
Recomendaciones para el estudio anatomopatológico de las muestras:
1. Las biopsias obtenidas por punción (ej. core, mammotome, etc) deben ser incluidas en su totalidad y estudiadas con secciones histológicas por lo menos 1 corte completo de cada una y coloreadas con técnicas de hematoxilina-eosina.
2. La pieza quirúrgica debe ser orientada según las referencias y entintada en su totalidad (ejemplo: tinta china) y seccionarla en rodajas de 3 a 5 mm. Identificar el sitio de la marcación.
En caso de considerarse necesario dichas secciones pueden ser remitidas a control mamográfico.
Se deberá incluir en forma separada con la identificación correspondiente los márgenes de la pieza quirúrgica y la zona de la lesión. De ser factible realizar la inclusión total del material.
El examen microscópico rutinario comprende una sección completa de cada muestra procesada,
coloreada con Hematoxilina-Eosina.
El informe histopatológico deberá incluir en el caso de carcinomas (invasores ó in situ) las
especificaciones de TNM (AJCC/ UICC TNM 6º EDITION revisión 2005). Específicamente a aquellas referidas al: tamaño tumoral / tipo histológico / grado histológico / embolias neoplásicas vasculares (linfáticas o sanguíneas) / márgenes.
El margen debe ser evaluado en cuanto a su compromiso: unifocal, multifocal y de ser extenso,
consignar la medida de la misma.
En caso de no estar comprometido consignar la distancia del tumor al margen más cercano (expresado en mm). En todas las situaciones mencionar cuál es el o los márgenes involucrados.
Siempre debe establecerse la correlación de la imagen histológica con la mamográfica. Si la lesión fue remitida por microcalcificaciones su presencia debe ser confirmada así como su localización.
En los casos de no concordancia de los hallazgos histológicos con los mamográficos, se recomiendan cortes seriados del material incluido en parafina, inclusión total del material y/o control mamográfico de los tacos de inclusión.
El patólogo considerará la utilización del material para realizar técnicas adicionales (ejemplo:
inmunohistoquímica).
NOTA: LES RECOMIENDO QUE VEAN EL EL VINCULO (DIRECCIÓN QUE PUSE AL PRINCIPIO) LAS IMAGENES Y OTROS GRAFICOS QUE SE ME COMPLICARON ESCANEAR PORQUE ESTAN BUENAS...Saludos GABI